نگاهی به تحول صنعت داروسازی با توسعه ابزارهای هوش مصنوعی
داروسازی به سبک آینده
با رایج شدن توسعه داروهای زیستی که با الگو گرفتن یا در برخی موارد مهندسی مولکولهای زیستی طبیعی تولید میشود، استفاده از روشهای نوین و فناوریهای پیشرفته برای طراحی داروهای جدید که بتواند علاوهبر کارایی بهتر، به صورت اختصاصیتر فقط روی اندام هدف تأثیرگذار باشد در دهههای اخیر بهشدت موردتوجه قرار گرفته است.
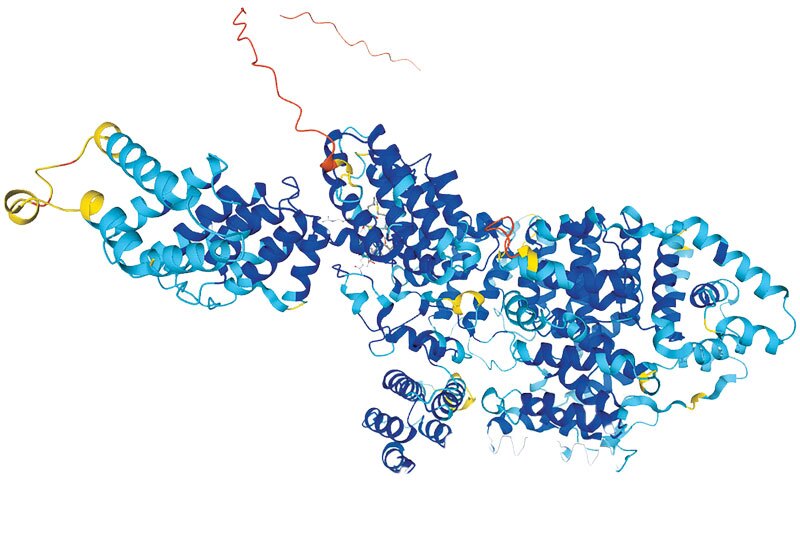
ازابزارهای مهم و ضروری برای تولید داروهای زیستی، پیشبینی ساختار سهبعدی پروتئینهای مختلف در داخل بدن است تا بتوان با شناخت بهتر آنها، نحوه اثرگذاریشان را در داروهای زیستی تقلید کرد و شرایط بیماری را بهبود بخشید؛ ابزاری که تا چند سال پیش خیلی قابل اعتماد نبود و فقط در مورد برخی از پروتئینها توسعه پیدا کرده بود. توسعه هوش مصنوعی در این سالها امکان جدیدی را برای محققان فراهم کرد که بتوانند با دقت بسیار بالایی ساختار سهبعدی همه پروتئینهای طبیعی و مصنوعی را پیشبینی کنند و از آنها برای تولید داروهای جدید بهره ببرند. معرفی ابزار هوش مصنوعی آلفافولد از سوی شرکت دیپمایند گوگل سر و صدای زیادی در دنیای زیستشناسی بهپا کرد؛ ابزاری که ساختار سهبعدی همه پروتئینها را میتواند پیشبینی کند. اما آیا استفاده از هوش مصنوعی در این مسیر فقط توسعه داروهای مفید کمک خواهد کرد؟
صنعت داروسازی از آن دست صنایعی است که طی قرنها با تحولات گستردهای روبهرو بوده و پیشرفتهای چشمگیری داشته است. در دهههای اخیر با توجه به پیشرفتهای علمی و فناوری و شکلگیری حوزههای بینرشتهای مانند نانوفناوری و زیستفناوری، مفهوم تولید دارو نیز با تحول عظیمی روبهرو شد و رفتهرفته نقش داروهای زیستی با اثرگذاری بیشتر و عوارض جانبی کمتر پررنگتر شد. این گروه از داروها با الگو قراردادن مولکولهای زیستی برای درمان اختصاصیتر بیماریها تولید میشوند اما برای توسعه این گروه از داروها نیاز بود تا ساختار مولکولهای مختلف زیستی در بدن مانند آنتیبادیها و گیرندههای مختلف سلولی بهدرستی پیشبینی شود. با توسعه ابزار هوش مصنوعی آلفافولد که میتواند ساختار سهبعدی پروتئینها را با دقت بسیار بالایی پیشبینی کند، به نظر میرسید که قرار است روند توسعه داروها کاملا متحول شود اما حالا پس از یکی دو سال بررسی عملکرد این ابزار برخی ازمحققان چندان هم مطمئن نیستند که این هوشمصنوعی همانقدر که انتظار میرفت، بتواند در افزایش سرعت شناسایی داروهای جدید موثر باشد.
عملکرد چالشبرانگیز
گروهی از محققان در پژوهشی جدید از ابزار پیشبینی ساختار پروتئین آلفافولد برای شناسایی صدهاهزار مولکول اثرگذار بر سیستم عصبی جدید استفاده کردهاند که میتواند به توسعه انواع جدیدی از داروهای ضدافسردگی کمک کند. این تحقیق برای اولین بار نشان میدهد که پیشبینیهای آلفافولد که فقط با لمس یک دکمه در دسترس است، میتواند به همان اندازه برای کشف دارو مفید باشد که ساختارهای پروتئینی که با روشهای آزمایشگاهی شناسایی میشود و معمولا ماهها یا حتی سالها ممکن است تعیین شدنشان زمان ببرد. ینس کارلسون، شیمیدان محاسباتی دانشگاه اوپسالا در سوئد میگوید: «آمدن هوش مصنوعی و توسعه دادهپایگاهی مانند آلفافولد انقلاب بزرگی در دنیای مولکولهای زیستی بهپا کرد؛ اگر ساختار دقیقی از پروتئینهای موردنیاز داشته باشیم، میتوان از آنها برای طراحی دارو استفاده کرد.» با این وجود دهها مقاله هم نشان داده است زمانی که از نتایج حاصل از پیشبینیهای هوش مصنوعی آلفافولد برای طراحی داروهایی که قرار است مولکولی پروتئینی به جایگاه خاصی متصل شود، به اندازه روشهای تجربی، مانند کریستالوگرافی اشعه ایکس، دقیق و موثر نبوده است و واکنشهای پیامرسانی که بر اثر اتصال پروتئین به جایگاه هدف باید شکل بگیرد، بهخوبی انجام نمیشود.
روشهای تجربی در برابر پیشبینی هوش مصنوعی
به دنبال چالشهای بهوجود آمده در خصوص کارایی استفاده از هوش مصنوعی در تعیین ساختار پروتئینهای دارویی گروهی از محققان به سرپرستی شویچت و برایان راث، زیستشناسان ساختاری در دانشگاه کارولینای شمالی از پیشبینیهای آلفافولد برای دو پروتئین که در فرآیند اثرگذاری داروهای شناختهشده اعصاب و روان دربدن نقش ایفا میکنند، استفاده کرد. دانستن ساختار پروتئینی که قراراست درفرآیند استفاده ازداروها دربدن موردهدف قرار بگیرد، کمک میکند تا از میان هزاران مولکول مختلف، بهترین ترکیب که دقیقترین پیوند را با پروتئین هدف برقرار میکند به عنوان کاندید دارو انتخاب شود. محققان درپی پاسخ به این پرسش بودند که آیا تفاوتهای کوچک نسبت به ساختارهای تجربی ممکن است باعث شود ساختارهای پیشبینیشده نتوانند به ترکیبات خاصی اتصال پیدا کند که در شرایط طبیعی بدن به پروتئین هدف متصل میشود و بر همین اساس ترکیباتی را به عنوان کاندید دارو پیشنهاد دهد که درشرایط طبیعی اثرگذاری خاصی روی پروتئین اصلی ندارد؟برای آزمایش این ایده، تیم تحقیقاتی از ساختارهای به دست آمده از روشهای تجربی برای این دو پروتئین استفاده کردند تا به صورت مجازی صدها میلیون داروی بالقوه را غربال کنند والبته همین کار را برای ساختارهای به دستآمده ازهوشمصنوعی هم تکرار کردند.
درنهایت کاندیدهای دارویی به دست آمده از هر دو روش را در آزمایشگاه مورد آزمون قرار دادند تا اثرگذاری آنها را رصد کنند. نتیجه نهایی این آزمون کاملا حیرتانگیز بود؛ ترکیبات پیشنهادی از هر یک از روشها کاملا متفاوت بود و حتی یک کاندید دارویی مشترک هم بین این دو روش شناسایی نشد. حتی به گفته سرپرست این مطالعه هیچیک از آنها به هم شبیه هم نبود.با این وجود نرخ اثرگذاری- تعداد ترکیباتی که توانسته بودند به صورت موثری عملکرد پروتئین هدف را تغییر دهند- در میان ترکیبات پیشنهادی هر دو روش تقریبا یکسان بود.
تحول بزرگ
با وجود این که بسیاری از پیشبینیهای ساختاری از سوی هوش مصنوعی آلفافولد دقیق نیست و ممکن است حتی در همان غربالگری اولیه هم به دلیل نامناسب بودن از ادامه روند تحقیقات خارج شود اما شویچت معتقد است که حدود یکسوم از نتایج حاصل از این پایگاه میتواند برای شروع کردن پروژه طراحی داروی جدید مورد استفاده قرار بگیرد. همین نرخ هم به اندازه کافی جذاب است و میتواند سرآغاز فصل جدیدی برای صنعت داروسازی و سرعتبخشی به روند طراحی و تولید داروهای جدید باشد. واقعیت این است که نمیتوان گفت هوش مصنوعی در این زمینه توانسته بازی را از دست محققان روشهای تجربی خارج کند و یکهتاز آینده صنعت داروسازی باشد اما به نظر میرسد میتواند مکمل خوبی برای روشهای تجربی باشد تا علاوهبر اینکه روند مراحل اولیه طراحی دارو سریعتر و مقرونبه صرفهتر شود، با تولید داروهای دقیقتر، مراحل بعدی کارآزمایی دارو هم بهتر و سریعتر پیش برود.
برگرفته از nature.com و alphafold.ebi.ac.uk
صنعت داروسازی از آن دست صنایعی است که طی قرنها با تحولات گستردهای روبهرو بوده و پیشرفتهای چشمگیری داشته است. در دهههای اخیر با توجه به پیشرفتهای علمی و فناوری و شکلگیری حوزههای بینرشتهای مانند نانوفناوری و زیستفناوری، مفهوم تولید دارو نیز با تحول عظیمی روبهرو شد و رفتهرفته نقش داروهای زیستی با اثرگذاری بیشتر و عوارض جانبی کمتر پررنگتر شد. این گروه از داروها با الگو قراردادن مولکولهای زیستی برای درمان اختصاصیتر بیماریها تولید میشوند اما برای توسعه این گروه از داروها نیاز بود تا ساختار مولکولهای مختلف زیستی در بدن مانند آنتیبادیها و گیرندههای مختلف سلولی بهدرستی پیشبینی شود. با توسعه ابزار هوش مصنوعی آلفافولد که میتواند ساختار سهبعدی پروتئینها را با دقت بسیار بالایی پیشبینی کند، به نظر میرسید که قرار است روند توسعه داروها کاملا متحول شود اما حالا پس از یکی دو سال بررسی عملکرد این ابزار برخی ازمحققان چندان هم مطمئن نیستند که این هوشمصنوعی همانقدر که انتظار میرفت، بتواند در افزایش سرعت شناسایی داروهای جدید موثر باشد.
عملکرد چالشبرانگیز
گروهی از محققان در پژوهشی جدید از ابزار پیشبینی ساختار پروتئین آلفافولد برای شناسایی صدهاهزار مولکول اثرگذار بر سیستم عصبی جدید استفاده کردهاند که میتواند به توسعه انواع جدیدی از داروهای ضدافسردگی کمک کند. این تحقیق برای اولین بار نشان میدهد که پیشبینیهای آلفافولد که فقط با لمس یک دکمه در دسترس است، میتواند به همان اندازه برای کشف دارو مفید باشد که ساختارهای پروتئینی که با روشهای آزمایشگاهی شناسایی میشود و معمولا ماهها یا حتی سالها ممکن است تعیین شدنشان زمان ببرد. ینس کارلسون، شیمیدان محاسباتی دانشگاه اوپسالا در سوئد میگوید: «آمدن هوش مصنوعی و توسعه دادهپایگاهی مانند آلفافولد انقلاب بزرگی در دنیای مولکولهای زیستی بهپا کرد؛ اگر ساختار دقیقی از پروتئینهای موردنیاز داشته باشیم، میتوان از آنها برای طراحی دارو استفاده کرد.» با این وجود دهها مقاله هم نشان داده است زمانی که از نتایج حاصل از پیشبینیهای هوش مصنوعی آلفافولد برای طراحی داروهایی که قرار است مولکولی پروتئینی به جایگاه خاصی متصل شود، به اندازه روشهای تجربی، مانند کریستالوگرافی اشعه ایکس، دقیق و موثر نبوده است و واکنشهای پیامرسانی که بر اثر اتصال پروتئین به جایگاه هدف باید شکل بگیرد، بهخوبی انجام نمیشود.
روشهای تجربی در برابر پیشبینی هوش مصنوعی
به دنبال چالشهای بهوجود آمده در خصوص کارایی استفاده از هوش مصنوعی در تعیین ساختار پروتئینهای دارویی گروهی از محققان به سرپرستی شویچت و برایان راث، زیستشناسان ساختاری در دانشگاه کارولینای شمالی از پیشبینیهای آلفافولد برای دو پروتئین که در فرآیند اثرگذاری داروهای شناختهشده اعصاب و روان دربدن نقش ایفا میکنند، استفاده کرد. دانستن ساختار پروتئینی که قراراست درفرآیند استفاده ازداروها دربدن موردهدف قرار بگیرد، کمک میکند تا از میان هزاران مولکول مختلف، بهترین ترکیب که دقیقترین پیوند را با پروتئین هدف برقرار میکند به عنوان کاندید دارو انتخاب شود. محققان درپی پاسخ به این پرسش بودند که آیا تفاوتهای کوچک نسبت به ساختارهای تجربی ممکن است باعث شود ساختارهای پیشبینیشده نتوانند به ترکیبات خاصی اتصال پیدا کند که در شرایط طبیعی بدن به پروتئین هدف متصل میشود و بر همین اساس ترکیباتی را به عنوان کاندید دارو پیشنهاد دهد که درشرایط طبیعی اثرگذاری خاصی روی پروتئین اصلی ندارد؟برای آزمایش این ایده، تیم تحقیقاتی از ساختارهای به دست آمده از روشهای تجربی برای این دو پروتئین استفاده کردند تا به صورت مجازی صدها میلیون داروی بالقوه را غربال کنند والبته همین کار را برای ساختارهای به دستآمده ازهوشمصنوعی هم تکرار کردند.
درنهایت کاندیدهای دارویی به دست آمده از هر دو روش را در آزمایشگاه مورد آزمون قرار دادند تا اثرگذاری آنها را رصد کنند. نتیجه نهایی این آزمون کاملا حیرتانگیز بود؛ ترکیبات پیشنهادی از هر یک از روشها کاملا متفاوت بود و حتی یک کاندید دارویی مشترک هم بین این دو روش شناسایی نشد. حتی به گفته سرپرست این مطالعه هیچیک از آنها به هم شبیه هم نبود.با این وجود نرخ اثرگذاری- تعداد ترکیباتی که توانسته بودند به صورت موثری عملکرد پروتئین هدف را تغییر دهند- در میان ترکیبات پیشنهادی هر دو روش تقریبا یکسان بود.
تحول بزرگ
با وجود این که بسیاری از پیشبینیهای ساختاری از سوی هوش مصنوعی آلفافولد دقیق نیست و ممکن است حتی در همان غربالگری اولیه هم به دلیل نامناسب بودن از ادامه روند تحقیقات خارج شود اما شویچت معتقد است که حدود یکسوم از نتایج حاصل از این پایگاه میتواند برای شروع کردن پروژه طراحی داروی جدید مورد استفاده قرار بگیرد. همین نرخ هم به اندازه کافی جذاب است و میتواند سرآغاز فصل جدیدی برای صنعت داروسازی و سرعتبخشی به روند طراحی و تولید داروهای جدید باشد. واقعیت این است که نمیتوان گفت هوش مصنوعی در این زمینه توانسته بازی را از دست محققان روشهای تجربی خارج کند و یکهتاز آینده صنعت داروسازی باشد اما به نظر میرسد میتواند مکمل خوبی برای روشهای تجربی باشد تا علاوهبر اینکه روند مراحل اولیه طراحی دارو سریعتر و مقرونبه صرفهتر شود، با تولید داروهای دقیقتر، مراحل بعدی کارآزمایی دارو هم بهتر و سریعتر پیش برود.
برگرفته از nature.com و alphafold.ebi.ac.uk

تازه ها
پیشنهاد سردبیر

گواردیولا چگونه برترین مربی تاریخ شد؟
واقعیتهای تلخ «پپ»



خرید و فروش غیرقانونی انواع حیوانات و پرندگان کمیاب ادامه دارد
دستبرد تخصصی به حیات وحش
گفت و گو



در گفتوگوی جام جم آنلاین با حجتالاسلام دکتر قاسم خانجانی بررسی شد
ضرورت مشابهسازی تاریخی جریانها و رویدادها به جای اشخاص
















